Rutherfords kjernemodell for atomet
I 1904, sette J.J.Thomson fram sin bollemodell for atomet. Den kunne gjera rede for at elektronet var ein del av atomet,og for atomets elektriske nøytralitet, men den kunne ikkje forklara det Rutherford, Geiger og Marsden hadde kome fram til i sine eksperiment, nemlig at alfapartiklar som blir skotne mot ein tynn metallfollie kan bli sendt tilbake. Som svar på dette sette Rutherford fram sin kjernemodell. Skjematisk kan vi tenkja oss den slik:
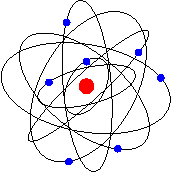 .I midten
er kjerna og rundt den beveger elektronane seg. Rutherford tenkte seg at
dei bevega seg i banar rundt kjernen omtrent som planetar rundt sola. Nesten
heile atomets masse er samla i kjerna. Men atomets radius er mellom 10 000
og 100 000 gonger større enn kjerna. Det betyr at det meste av atomet
er tomrom.
.I midten
er kjerna og rundt den beveger elektronane seg. Rutherford tenkte seg at
dei bevega seg i banar rundt kjernen omtrent som planetar rundt sola. Nesten
heile atomets masse er samla i kjerna. Men atomets radius er mellom 10 000
og 100 000 gonger større enn kjerna. Det betyr at det meste av atomet
er tomrom.
Det meste av dette blir fremdeles rekna som riktig. Men denne modellen har også sine problemer. Det alvorligste er dette: I følge klassisk fysikk vil ein ladd partikkel som er akselerert (dvs. som svinger eller vibrerer ell.) senda ut elektromagnetisk stråling. Denne strålingen har energi, og denne energien må komma frå partikkelen. Derfor vil partikkelen sjøl tapa energi. Konkret: eit elektron som går i ein sirkelbane rundt ei kjerne er akselerert, (Den har en akselerasjon retta innover i banen) og det vil derfor sende ut stråling og tapa kinetisk energi. Det vil i bety at det vil endra bane og gå i en sirkelbane som er nærare kjernen. Elektronet vil altså heile tida tape energi og komma nærmare og nærmare kjerna, for til slutt å kollidera med kjerna.
Sagt på en annan måte: I følge klassisk fysikk må Rutherford-atom vera ustabilt, og vil kollapsa etter kort tid. Men dette er jo i strid med fakta. Altså kan ikkje Rutherfords modell vera riktig, eller i alle fall ikkje fullstendig. Modellen forklarar ikkje elektronets bevegelsar rundt kjerna. Det første forsøket på å gjera det kom Niels Bohr med.
Lenker
http://dbhs.wvusd.k12.ca.us/webdocs/AtomicStructure/Thomson-Model-Intro.html
